|
——背景—— 别构调控在多种生物学过程中广泛存在,已知别构蛋白质的异常调控与多种疾病密切相关,例如癌症、血液病、心血管疾病、糖尿病和中枢神经系统疾病等。由于具有高特异性与可以克服耐药性突变等独特优势,别构药物具有重要的治疗价值,然而目前上市的别构药物数量还很有限。理解蛋白质序列、结构和别构调控功能之间的关系可以促进对别构调控机制的理解,并有助于进行别构药物设计。 北京大学化学与分子工程学院/前沿交叉学科研究院定量生物学中心/北大-清华生命科学联合中心/北京大学成都前沿交叉生物技术研究院来鲁华教授课题组近日受邀在Journal of Molecular Biology上发表了题为“Sequence and Structure-based Prediction of Allosteric Sites”的综述论文。该文章总结了目前已上市的别构药物与近期发展的基于序列和结构的别构位点预测方法,评述了近期理性别构药物设计的实例,并讨论了别构药物设计未来的可能发展趋势。 ——FDA已批准的别构药物—— 为了从已上市的别构药物中学习相关规律,作者首先收集了FDA已批准的小分子别构药物的数据。截至2025年2月22日,FDA已批准了2813种新的小分子药物,其中只有33种为通过别构效应发挥作用,表明别构药物发现还存在着很大的空间与挑战。不少在体外和动物实验上表现优秀的候选别构药物由于在临床试验中的疗效不足而未能上市,例如Dalzanemdor(在二期临床试验中失败)、Emraclidine(在二期临床试验中失败)和Amcenestrant(在三期临床试验中失败)。作者分析了这些已批准的别构药物与其靶蛋白的复合物结构(图1)、别构药物的化学结构、发现方法、潜在的别构调控机制、首次批准的时间及其适应症等。其中GPCRs和GABAA受体是目前别构药物开发最多的靶标,这类靶标的正构(功能)位点在亚型间高度保守,导致正构药物缺乏选择性和具有严重的副作用。相比之下,别构分子可以通过对某些亚型的特异性结合,从而对特定靶标的生物学功能进行选择性调控。KRas是GTP酶家族的成员,在多个与癌症相关的通路中起着关键作用。由于其表面较为平滑,缺乏明显的药物结合口袋,而Ras家族各亚型中的GTP结合位点高度保守,因此KRas长期以来被认为是一个“不可药”的靶标。直到2021年和2022年FDA分别批准了可以结合在KRas G12C一个隐藏别构口袋中的抑制剂Sotorasib和Adagrasib,这个挑战才得到部分解决。 目前,别构药物的设计仍面临重大挑战。大多数已上市的别构分子是通过体外筛选或内源性分子的改造来发现的,其别构调控机制在后续的计算和实验研究中被逐渐揭示出来。Xanomeline最初是为毒蕈碱乙酰胆碱受体(mAChR)上的乙酰胆碱结合位点开发的,后来的研究发现其具有正构和别构两种结合模式,显著增强了其对M1和M4亚型的选择性。随着对药物作用机制理解的深入,一些先前被认为是正构的药物也被发现具有别构效应。例如,Selinexor主要通过直接与Exportin 1(XPO1)的正构配体竞争来发挥作用,但进一步的研究发现它也具有别构降解活性,可以促进XPO1与E3连接酶的结合,并通过蛋白质酶体途径触发蛋白质降解。另一个案例为腺苷A2A受体(A2AR),其以四聚体形式存在,包含两个结合位点。最初被认为是A2AR的竞争性抑制剂的Istradefylline,近期被发现可以别构抑制腺苷在另一位点的结合。这表明别构药物的调控类型可能比目前报道的更为多样。 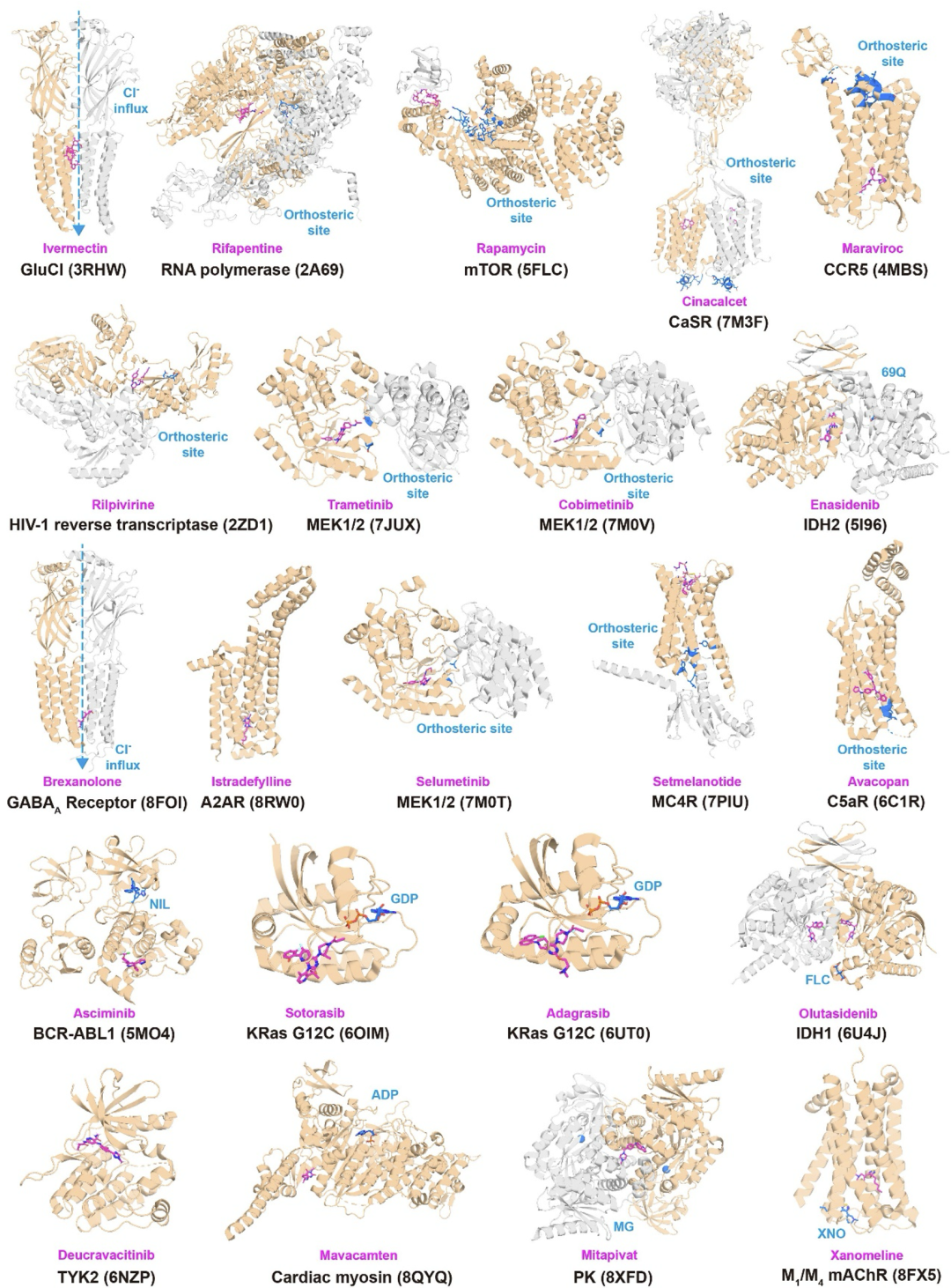 图1. FDA批准的别构药物与其靶蛋白的代表性复合物结构。 ——基于结构和序列的别构位点预测方法的最新进展—— 理性别构药物设计需要基于对别构位点的正确识别。然而,目前已知的别构位点数量有限,实验方法确定别构位点复杂耗时。因此,对于基于蛋白质结构和序列来预测别构位点的计算方法有很大的需求,目前已有的一些代表方法见表1。基于蛋白质结构的预测方法主要通过提取物理化学信息、分析蛋白质运动模式以及构建残基/结构域网络来预测别构位点。例如,本课题组基于蛋白质结构和高斯网络模型分析了不同运动模式下别构位点和正构位点之间的运动相关性,揭示了别构调控的主导运动模式并进一步发展了高精度别构位点预测方法CorrSite2.0。CorrSite2.0已经被整合到CavityPlus 2022网站中,用户只需输入单体或多聚体蛋白质结构就可预测别构位点。在随后的研究中,本课题组进一步基于蛋白质结构构建了折叠层面的蛋白质拓扑图,并发展了仅基于蛋白质整体拓扑结构来预测别构位点的方法TopoAlloSite。由于TopoAlloSite无需进行口袋探测,因此也特别适合用于识别隐藏别构位点。基于结构的别构位点预测方法还包括AlloReverse和PASSer等。但由于这些预测方法均依赖于蛋白质结构信息和口袋检测算法,不适用于未知蛋白质结构或涉及高度柔性的结合位点(如固有无序)的情况。 蛋白质序列包含丰富的进化信息,近年来已经发展了一些基于序列的别构位点预测方法,如基于多序列比对(MSA)或蛋白质语言模型(pLMs)的方法。例如,本课题组通过利用进化耦合模型从MSA中提取残基共进化信息发展了别构位点和关键别构残基的预测方法KeyAlloSite。Kannan等人利用蛋白质语言模型ESM-1b来计算模型生成的所有attention map的平均值,发现与活性位点残基有高attention的残基在别构相互作用中显著富集。他们将每个残基与活性位点残基的attention进行求和并将这个和作为每个残基的最终得分。再根据得分对残基进行排名,将靠前的残基预测为别构残基。但当某个蛋白质的同源序列数量较少时,基于MSA的方法难以准确预测其别构位点。同时,基于蛋白质语言模型的别构位点预测方法缺乏可解释性,难以从attention map中准确提取别构信息,别构位点的预测精度仍有待提高。因此,如何更好地利用蛋白质语言模型生成的进化信息并开发具有可解释性的深度学习模型仍需进一步探索。 表1. 代表性的基于结构和序列的别构位点预测方法(具体文献见原文) 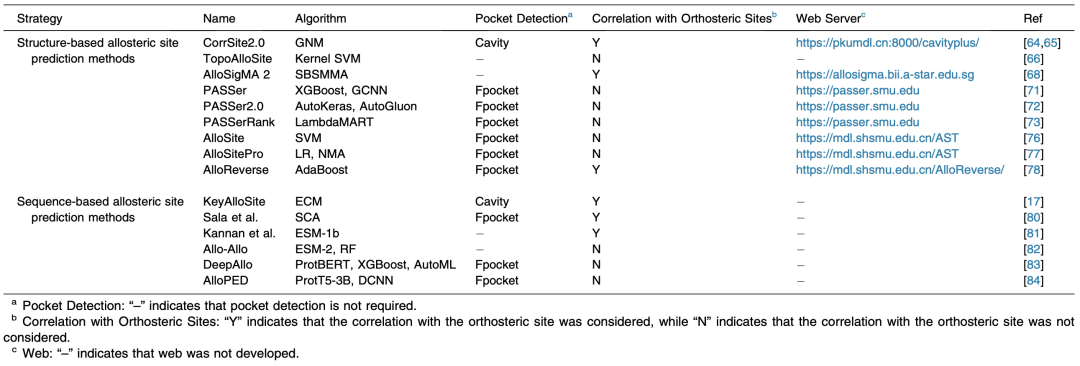 ——隐藏别构位点的形成与预测—— 隐藏别构位点是指那些在静态的自由态结构中不可见,仅在特定配体结合后的复合物结构中才会打开的别构位点,对于困难靶标药物发现具有重要意义。隐藏别构位点的形成主要由蛋白质结构中的表面环区、结构域或二级结构的变化或运动所驱动(图2)。Lazou等人研究了已知隐藏位点的蛋白质及其配体,发现隐藏口袋打开的机制在很大程度上决定了隐藏位点的潜在可药性。具体来说,主要由表面环区运动或铰链运动形成的隐藏位点具有很大的作为药物靶标的潜力,而由侧链运动形成的位点通常不能和类药分子形成足够强的结合能力。 目前大多数别构位点预测方法依赖于首先在静态结构中找口袋,然后预测找到的口袋中哪些是潜在的别构口袋。由于在自由态蛋白结构中难以观察到隐藏别构位点,因此常规别构位点预测方法难以识别隐藏别构位点。近年来,发展了一些计算方法来理性发现隐藏别构位点。最常用的计算方法是分子动力学(MD)模拟,包括长时间尺度MD、加速MD和混合溶剂MD,这些方法可以模拟蛋白质随时间的运动,从而捕获隐藏口袋打开的瞬态构象。例如,Gupta等人通过对p37酶与抑制剂进行结构建模和500 ns的MD模拟,首次观察到抑制剂从活性位点动态翻转到p37的一个隐藏别构位点,并别构抑制了活性位点的功能。但由于分子动力学模拟需要大量的资源,并且隐藏别构位点变得可见的时间尺度是无法预先判断的,有时甚至在当前计算方法无法达到的时间尺度内。例如,Gervasio课题组对TEM1 β-内酰胺酶与苯进行了混合溶剂MD模拟,模拟时间超过1 μs,但只得到了1/3开放的隐藏口袋。通过增强采样技术,可以在较短的模拟时间内揭示隐藏别构位点。然而,采样协议必须针对特定的蛋白体系进行定制,因为过于激进的方法可能会导致蛋白质变性。例如,Gervasio课题组也尝试采用了SWISH增强采样方法,他们发现在100纳秒的模拟时间内可以成功打开TEM1 β-内酰胺酶的隐藏口袋,但过度扰动哈密顿量可能会导致蛋白质解折叠。 近年来,人工智能技术的进步对生物学研究产生了显著影响,尤其是在蛋白质结构预测方面,这也促进了基于人工智能的隐藏别构位点发现方法的发展。例如,Meller等人开发了一种深度学习方法PocketMiner,这是一种在MD模拟数据上训练的图神经网络,能够预测哪些口袋在MD模拟过程中可能会打开,从而识别隐藏位点。在之后的工作中,他们对MSA进行随机采样作为AlphaFold2的输入,以生成蛋白质构象集合。他们的研究发现AlphaFold2可以采样到打开或部分打开的隐藏口袋,这些口袋可以作为MD模拟的起始构象,从而加速隐藏位点的发现。类似地,Vani等人发展了AlphaFold2-RAVE,主要利用AlphaFold2生成大量潜在构象作为AI增强MD模拟的初始构象。虽然基于人工智能的方法严重依赖现有数据,有限的数据规模和多样性可能导致模型缺乏泛化能力,但随着人工智能技术的进步和别构数据的增加,基于人工智能的方法将有望极大地促进隐藏别构位点的发现。 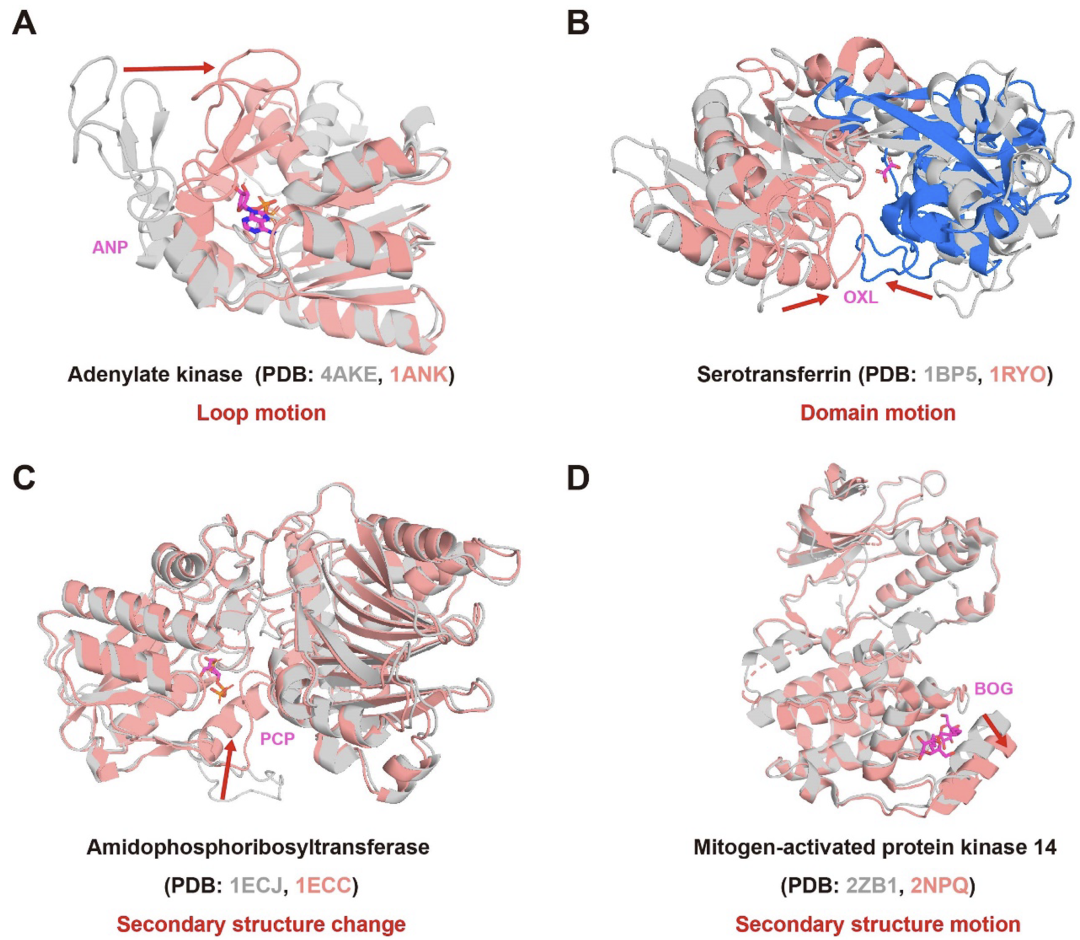 图2. 不同类型的构象变化导致隐藏别构位点的形成。 ——理性别构药物设计案例—— 尽管别构药物发现还存在很大挑战,但计算方法的发展正在加速别构药物的发现。通过组合各种别构位点预测方法与基于结构的药物设计工具,别构药物发现的早期过程可以在计算机内进行,以减少对不可预测实验的依赖。 CavityPlus是本课题组开发的一个在线药物设计平台,其集成了Cavity(用于检测可药口袋)、CavPharmer(用于基于靶标的药效团分析)、CorrSite(用于别构位点预测)、CovCys(用于可药共价Cys检测)和CavityMatch(用于口袋比较)的模块,能够进行蛋白质口袋检测和各种性质分析,包括药效团分析、别构位点预测、共价结合位点预测和口袋相似性搜索。由于其方便性和准确性,已经有多个用户基于CavityPlus预测的别构位点进行成功药物发现的案例被报道。例如,张等人使用CavityPlus平台和CorrSite2.0工具在丝氨酸/苏氨酸蛋白磷酸酶5(PP5)的TPR结构域和磷酸酶结构域之间识别出一个新的别构位点(图3A)。通过虚拟筛选、MM-GBSA自由能计算、分子合成和结构优化,最终的别构分子DDO-3733被证实可以别构激活PP5从而显著减少热休克蛋白的过表达。同时,研究发现DDO-3733并未影响其他几种磷酸酶的活性,表明其具有高选择性。 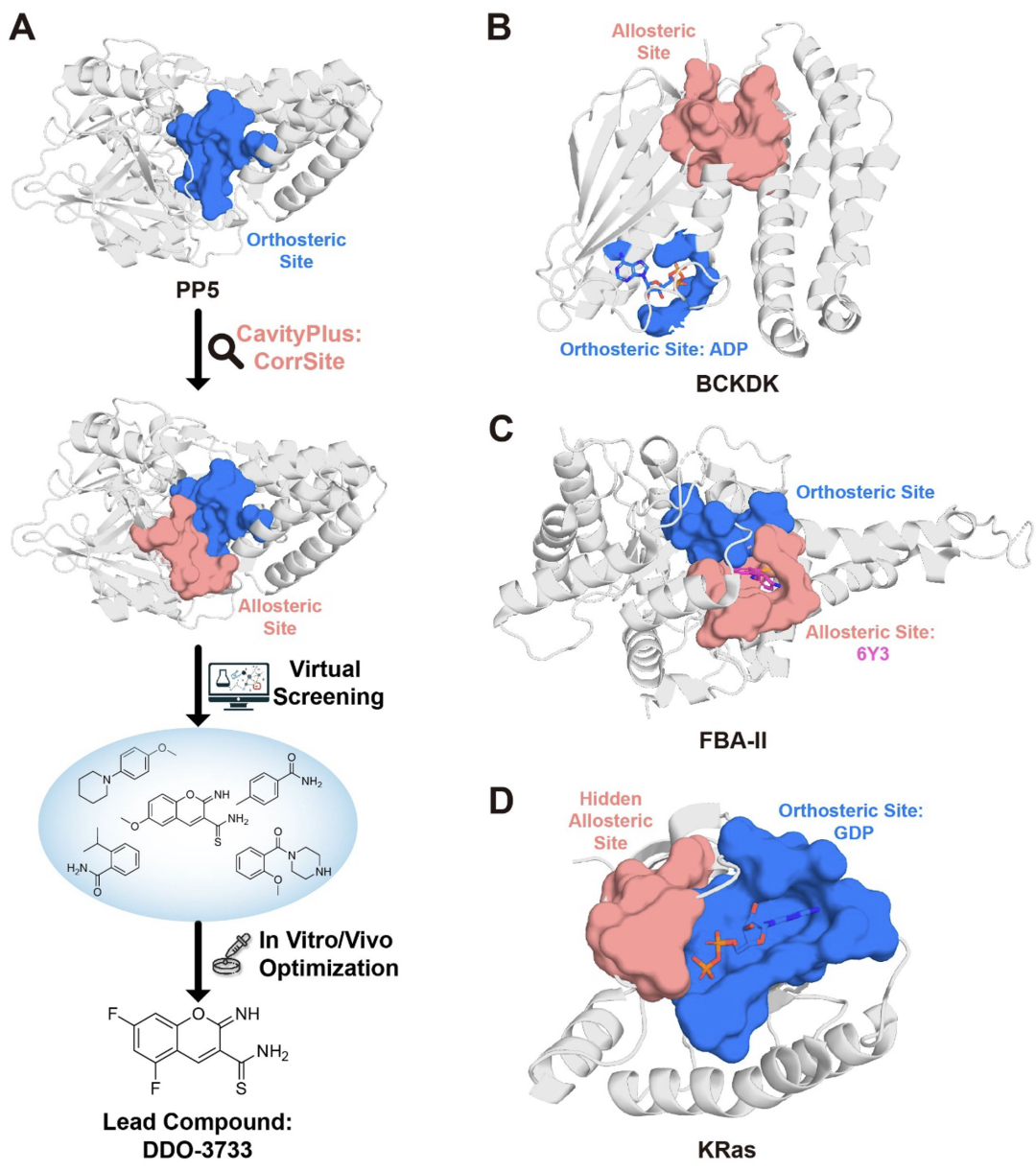 图3. 四种由计算辅助成功进行理性别构药物设计的实例。 ——小结—— 基于蛋白质结构和序列分析别构调控功能将有助于阐明别构调控的机制并加速计算机辅助的别构药物设计。尽管计算方法在预测别构位点方面取得了一些进步,但如何更好地整合包含序列和结构在内的多模态信息以提高别构位点的预测准确度仍需进一步探索。特别是隐藏别构位点目前仍然很难预测,发展能够更有效地利用结构、序列进化和拓扑等多方面信息,并且无需依赖传统口袋探测程序的机器学习方法将有助于更准确地预测潜在的隐藏别构位点。此外,虽然人工智能驱动的计算方法在预测别构位点方面取得了进展,但深度学习模型的可解释性仍然是一个问题。开发具有可解释性的深度学习模型用于预测别构位点将有助于阐明别构位点的调控机制和提高模型对新别构预测任务的泛化能力。与此同时,现有蛋白质-配体复合物结构预测方法如AlphaFold 3在蛋白质-别构配体复合物结构上的预测精度较低,这可能是由于缺乏蛋白质-别构配体复合物结构的训练数据。因此,实验自动化、饱和正构位点下的结合化合物高通量筛选以及更准确的蛋白质-配体复合物结构预测或确定方法的快速发展将为开发下一代别构位点预测方法生成大量数据。 北京大学化学与分子工程学院博士后谢娟和博士研究生潘高翔为该综述文章的共同第一作者,来鲁华教授为通讯作者。该研究得到了国家自然科学基金(22237002,T2321001)、中国医学科学院创新基金 (2021-I2M-5-014)和中国博士后科学基金(2023M740071)的资助。 参考文献: Xie, Juan; Pan, Gaoxiang; Lai, Luhua. "Sequence and Structure-based Prediction of Allosteric Sites." Journal of Molecular Biology (2025).  本文内容来源于网络,版权归原作者所有,如有侵权请联系删除,谢谢!
|  |Archiver|手机版|小黑屋|Octave中文网学术交流论坛
( 黑ICP备2024030411号-2 )
|Archiver|手机版|小黑屋|Octave中文网学术交流论坛
( 黑ICP备2024030411号-2 )