近日,在法国巴黎举行的第 41 届欧洲人类生殖与胚胎学学会(ESHRE)年会上,体外生殖领域先驱、日本大阪大学(University of Osaka)发育遗传学家林克彦Katsuhiko Hayashi教授表示,将成人皮肤或血细胞转化为卵子与精子的人类体外配子生成技术(IVG)正在快速推进,预计他的实验室还有大约 7 年的时间实现这一颠覆性技术。届时,这项技术将对生殖产生重大影响,甚至可能改变人类的生育方式。而且,他认为该技术或是解决全球人口老龄化和生育率下降等问题的潜在手段。 (林克彦 图源:网络)此前,林克彦因首次用两个雄性小鼠的细胞培养出了小鼠幼崽而入选 2023 年《自然》(Nature)年度十大人物。在此次会议上,林克彦展示了他们团队的最新进展,包括在实验室培养的睾丸类器官中成功培育出小鼠的原始精母细胞。但这些细胞在发育到精子细胞的前体阶段时死亡,未来他们希望通过改进类器官的氧气供应来解决这一问题。同时,他们已开发出人类卵巢类器官,有望在未来实现体外培育人类卵子。而从女性细胞中培育精子也或是可行的,尽管在技术上极具挑战。这项技术有望让不孕不育者、高龄人士乃至同性伴侣拥有诞下生物学后代的机会。但目前,该技术仍面临着巨大的安全与伦理挑战。相关机构正在探究如何确保实验室培育的精子和卵子的安全性,以及在临床应用之前需要完成哪些测试。 (林克彦 图源:网络)此前,林克彦因首次用两个雄性小鼠的细胞培养出了小鼠幼崽而入选 2023 年《自然》(Nature)年度十大人物。在此次会议上,林克彦展示了他们团队的最新进展,包括在实验室培养的睾丸类器官中成功培育出小鼠的原始精母细胞。但这些细胞在发育到精子细胞的前体阶段时死亡,未来他们希望通过改进类器官的氧气供应来解决这一问题。同时,他们已开发出人类卵巢类器官,有望在未来实现体外培育人类卵子。而从女性细胞中培育精子也或是可行的,尽管在技术上极具挑战。这项技术有望让不孕不育者、高龄人士乃至同性伴侣拥有诞下生物学后代的机会。但目前,该技术仍面临着巨大的安全与伦理挑战。相关机构正在探究如何确保实验室培育的精子和卵子的安全性,以及在临床应用之前需要完成哪些测试。小编也梳理了 Katsuhiko Hayashi 教授及相关学者的一些最新研究进展,供大家学习。 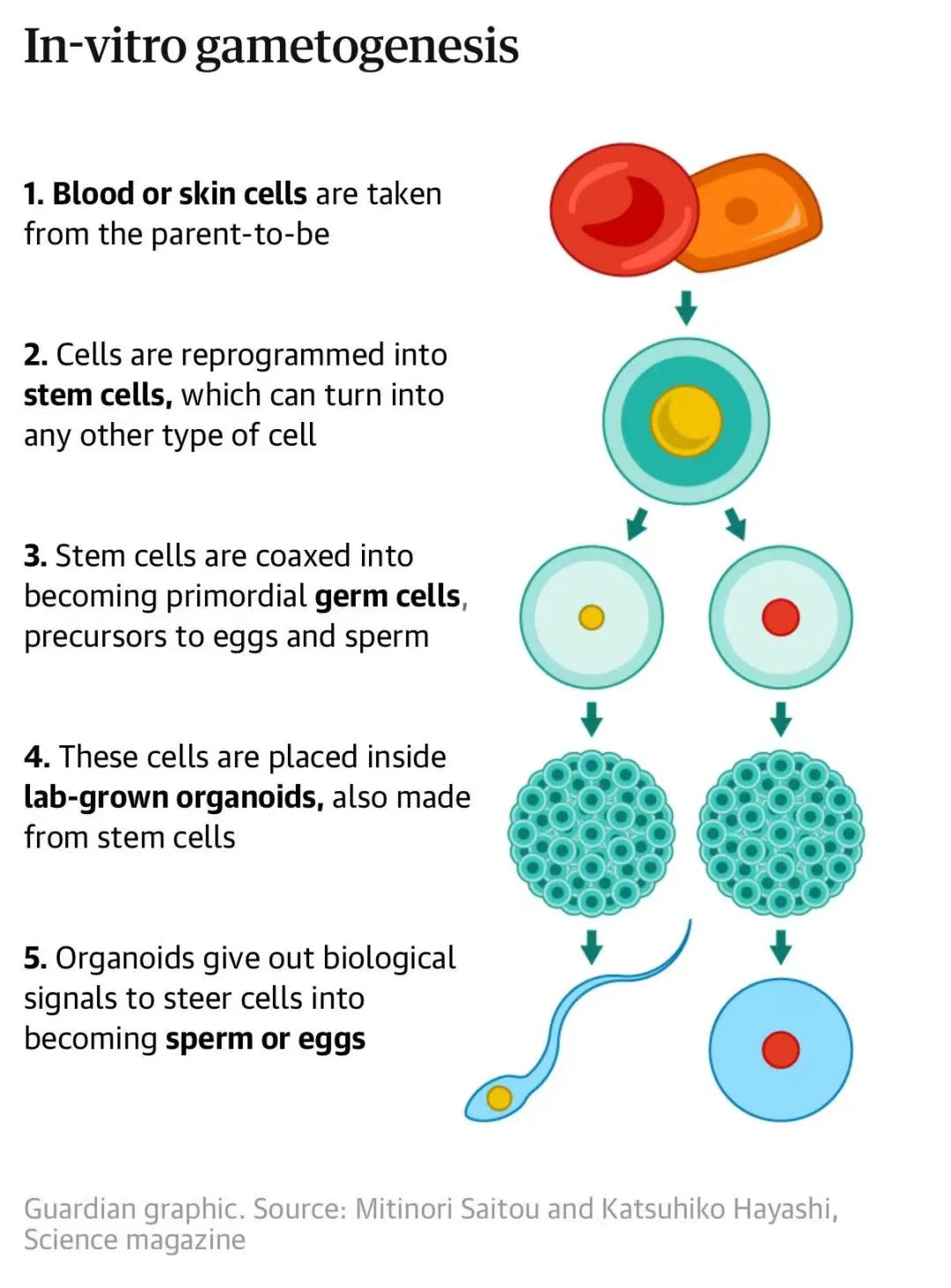 图 1 人类体外配子生成技术示意图(图源:《卫报》) 人工合成卵子技术 2020 年 12 月 16 日,日本九州大学医学研究生院干细胞生物学和医学系 Katsuhiko Hayashi 教授团队在 Nature 上发表了题为 Reconstitution of the oocyte transcriptional network with transcription factors 的论文。 在这项研究中,林克彦(Katsuhiko Hayashi)等人通过研究小鼠卵母细胞体外发育系统中基因表达的变化并进行相关的功能筛选,由此确定了一组8种足以触发卵母细胞生长的转录因子,每种转录因子都是从原始卵泡向初级卵泡过渡的关键。这8种转录因子为:Figla、Sohlh1、Lhx8、Nobox、Stat3、Tbpl2、Dynll1以及Sub1。并且,这些转录因子的编码基因的表达是相互影响的。
研究人员发现,这些转录因子的强制表达能迅速地将多能干细胞转化为卵母细胞样细胞。更重要的是,虽然这些卵母细胞样细胞没有进行减数分裂,但能够受精,并可以分裂到胚胎发育的8细胞阶段。然而,超过这一阶段的进一步发育还是会会受到影响。总的来说,这项研究揭示了卵泡生长的基因调控网络,并为辅助生殖技术提供新的材料来源。  图 2 相关研究(图源:Nature) 性染色体改造,雄性细胞转化为卵细胞 2023年3月8日,日本大阪大学林克彦(Katsuhiko Hayashi)教授在第三届人类基因组编辑国际峰会上宣布,他们使用雄性小鼠的细胞培育出了卵子,并且这些卵子可以与雄性精子受精,将其植入雌性小鼠体内,能够发育出健康、可育的后代。一周后的3月15日,Nature 正式发表了这项重磅研究成果,论文题为:Generation of functional oocytes from male mice in vitro。研究人员将携带男性 XY 染色体的皮肤细胞重新编程为干细胞样状态,即所谓的诱导多能干细胞(iPSCs)。然后删除这些细胞中的 Y 染色体,并替换为从另一个细胞「借用」的 X 染色体,以产生具有两条相同 X 染色体的诱导多能干细胞。随后,将该细胞放置在卵巢类器官(一种复制小鼠卵巢内条件的培养系统)中培养,使其变成卵子。并将该卵子与正常精子结合受精,获得了大约 600 个胚胎。这些胚胎被植入代孕小鼠体内,最终诞生了七只小鼠幼崽。这些小鼠均身体健康、寿命正常,并在成年后能够正常繁殖后代。 图 3 相关研究(图源:Nature) 原始生殖细胞的隐藏力量:早期胚胎注射揭示其原始多能性潜能 2025 年 5 月 14 日,日本九州大学医学研究生院干细胞生物学和医学系/大阪大学医学研究生院基因组生物学系林克彦(Katsuhiko Hayashi)教授团队联合英国伦敦帝国理工学院医学院临床科学研究所(ICS)的研究人员在 Developmental Cell 上发表论文 Determining the potency of primordial germ cells by injection into early mouse embryos 。 研究人员将带有 Oct4DPE-GFP 转基因的原始生殖细胞(PGCs)注射到 8 细胞阶段的小鼠胚胎中,观察其存活与增殖;随后分离出内细胞团(ICM)评估 PGCs 的整合和分化能力,并移植制备嵌合体小鼠。此外,研究人员还诱导 PGC 样细胞(PGCLCs)评估其嵌合能力,并通过 RNA 测序分析 PGC-胚胎干细胞(ESCs)的基因表达与分化潜能。 研究结果表明,注射到 8 细胞胚胎中的 PGCs 可以存活、增殖,并整合到 ICM 中,并表现出类似原始多能干细胞的特性。同时,凋亡缺陷型 PGCs 在 ICM 中表现出更好的存活率,并可以形成原始多能 ESC 细胞系(PGC-ESCs)。然而,凋亡缺陷型 PGCs 对植入后胚胎的发育贡献有限,没有观察到功能性整合。 值得一提的是,与体内来源的 PGCs 相比,PGCLCs 对中期嵌合体的贡献更大,这也进一步表明其保留了更强的原始多能性。总的来说,该研究提出了PGC形成在体内确立一种限制嵌合体贡献的潜在多能性的观点,为研究PGCs的发育潜能和重编程机制提供了新的工具,对理解PGCs的生物学特性和开发新的生殖细胞治疗策略具有重要意义。  图 4 相关研究(图源:Developmental Cell) 基于 Katsuhiko Hayashi 教授团队的上述研究,最近又有一些关于卵母细胞研究新的重磅发现! 无体细胞环境培育卵母细胞 2025 年 6 月 30 日,日本京都大学人类生物学高级研究所 Mitinori Saitou 教授团队在 Developmental Cell 上发表论文 Generation of germinal-vesicle oocytes from mouse embryonic stem cells under an ovarian soma-freecondition 。 为探讨如何在无卵巢体细胞(OSC)的条件下,从小鼠胚胎干细胞(mPSCs)中产生卵母细胞,研究人员使用了能够支持 PGC 生存的 m220 培养基细胞,建立了一个不含 OSC 的系统,来培养 mPGCLCs 以进行表观遗传重编程,并将其诱导进入减数分裂 I 期的胎儿卵母细胞阶段,证明了骨形态发生蛋白(BMP)信号通路及其下游转录调节因子 ZGLP1驱动卵原细胞向卵母细胞的分化。由于 m220 培养基细胞在 mPGC(LC)分化中没有指导作用,这一系统为不含 OSC 的体外卵子生成奠定了基础。 研究结果表明,作者提出的这种提出了不含 OSC 的体外卵母细胞生成系统,能够生成大量处于双有丝分裂中期的类似胎儿卵母细胞的细胞。借助关键细胞因子、信号激活剂和抗氧化剂,它们表现出显著的生长,并分化为在形态、转录组和组蛋白修饰特征方面与生殖囊卵母细胞相当的细胞,具备在生殖囊破裂时恢复减数分裂的能力。通过用最少的成分重建卵母细胞生成的主要阶段,该研究为哺乳动物(包括人类)不含 OSC 的体外卵母细胞生成奠定了基础。  图 5 相关研究(图源:Developmental Cell)  本文内容来源于丁香学术、环球科学科研圈等,版权归原作者所有,如有侵权请联系删除,谢谢!
|  |Archiver|手机版|小黑屋|Octave中文网学术交流论坛
( 黑ICP备2024030411号-2 )
|Archiver|手机版|小黑屋|Octave中文网学术交流论坛
( 黑ICP备2024030411号-2 )