|
抗病毒药物是一类专门用于治疗病毒感染的药物。尽管大多数抗病毒药物针对特定病毒,但广谱抗病毒药物能够对多种病毒起效。目前市面上的抗病毒药物主要集中于治疗 HIV(艾滋病毒)、疱疹病毒、乙型和丙型肝炎病毒,以及甲型和乙型流感病毒。近年来,随着新冠病毒(COVID-19)的全球大流行,针对冠状病毒的抗病毒药物也成为研发的重点。
肽类及其类似物抗病毒药物
许多抗病毒药物的通用名称以“vir”结尾,其化学结构往往具有肽类类似物的特点。例如阿扎那韦(atazanavir)、洛匹那韦(lopinavir)、奈非那韦(nelfinavir)、波普瑞韦(boceprevir)、特拉普韦(telaprevir)等。此外,还有一些名称以“tide”结尾的抗病毒药物,如布鲁伟肽(bulevirtide)。
肽类类似物的分子结构优势
与传统肽类药物相比,肽类类似物在结合力、代谢稳定性和生物利用度方面都有显著优势。通过化学修饰策略,将传统肽类药物转化为肽类类似物,能够进一步提升药物与受体的亲和力以及药代动力学特性,这成为抗病毒药物开发的重要路径。
常见的肽类修饰策略
由于传统肽类药物在代谢稳定性和口服生物利用度方面存在不足,研究人员通常采用化学修饰以改善其性能。以下是几种常见的修饰方法:
1. N端与C端修饰
最基础的化学修饰方式是用乙酰基封闭肽的N端,并将C端修饰为酰胺。这种方式能显著降低Nα端由于二酮哌嗪(DKP)介导的降解,尤其对分子量较小的肽类效果尤为明显。截至2021年,在62种上市短肽药物(由15个或更少氨基酸残基组成)中,有37种通过乙酰化、吡咯谷氨酸化或环化等方式对N端进行了修饰,仅9种线性肽保留了自由的Nα基团。图2. N-端修饰
 图3. C-端修饰 图3. C-端修饰
此外,C端还可引入α-酮酰胺(alpha-keto amide)结构,将酮羰基加入肽分子中,转化为可与受体形成共价键的肽类类似物。例如,波普瑞韦和特拉普韦这两种针对HCV病毒丝氨酸蛋白酶的肽类药物,便在其C端引入了α-酮酰胺结构,从而显著提升了化合物的效能和药代动力学性能。 图4. 含有α-酮酰胺结构(红色标注)的拟肽药物波普瑞韦(Boceprevir)和特拉普瑞韦(Telaprevir) 图4. 含有α-酮酰胺结构(红色标注)的拟肽药物波普瑞韦(Boceprevir)和特拉普瑞韦(Telaprevir)
硼酸结构作为另一种日益流行的共价药物,也被频繁引入到肽分子中。例如,在一项研究中,科学家将硼酸结构添加到寨卡病毒、西尼罗病毒和登革病毒蛋白酶的二肽抑制剂中,用其替代羧酸或酰胺基团。结果,衍生的硼酸抑制剂的亲和力提高了千倍。
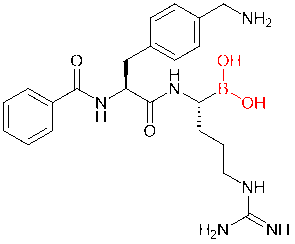 图5. 基于硼酸的抑制剂 2. 酰胺的类同电子取代肽骨架由酰胺键组成,这对其理化特性至关重要。通过类同电子取代策略,将酰胺键替换为类似结构,如酯、硫酰胺、1,2,3-三唑等,能够有效提升肽类药物的稳定性和活性。
以抗HIV药物沙奎那韦(saquinavir)为例,这款药物通过将肽主链中的酰胺键替换为羟甲基结构,大幅提升了代谢稳定性,成为早期成功的肽类类似物药物之一。 图6. 沙奎那韦的化学结构 图6. 沙奎那韦的化学结构
3. 氨基酸修饰通过将非蛋白氨基酸(如D-氨基酸)替代L-氨基酸,能够有效提高肽类药物的水解稳定性。例如,2021年上市的多款肽类药物(如voclosporin和odevixibat)都采用了D-氨基酸修饰策略,展现了良好的药效。  图7. 地氟卡肽的化学结构 图7. 地氟卡肽的化学结构
4. 环肽策略肽的环化被认为是提升其稳定性、药代动力学特性及生物利用度的关键手段之一。自上世纪80年代环孢素A(首个口服肽制剂)问世以来,环肽开发成为肽类药物研发的重要方向。目前,已有多款抗HCV环肽药物上市,如simeprevir、glecaprevir和voxilaprevir。 图8. 环肽抗病毒药物 图8. 环肽抗病毒药物
抗病毒肽类药物的研发前沿1. 抗新冠病毒药物新冠疫情爆发后,肽类类似物疗法的代表性药物——Paxlovid成为全球关注的焦点。Paxlovid包含两种活性成分:奈玛特韦(nirmatrelvir)和利托那韦(ritonavir)。其中,奈玛特韦是一种Mpro蛋白酶抑制剂,能够通过与病毒蛋白结合抑制其复制。而利托那韦则作为药代动力学增强剂,延长了奈玛特韦的半衰期和药物暴露时间。 图9. 硫醇化合物与腈化合物反应生成硫亚胺酸盐 图9. 硫醇化合物与腈化合物反应生成硫亚胺酸盐
2. 抗丙肝病毒药物抗HCV药物的研发已进入第三代阶段。第一代药物如波普瑞韦和特拉普韦主要针对NS3/4A蛋白酶,而后续的达拉他韦(daclatasvir)和索非布韦(sofosbuvir)则分别作用于NS5A和NS5B。最新一代的抗HCV环肽药物如glecaprevir和voxilaprevir,实现了对所有HCV基因型的覆盖,成为该领域的里程碑。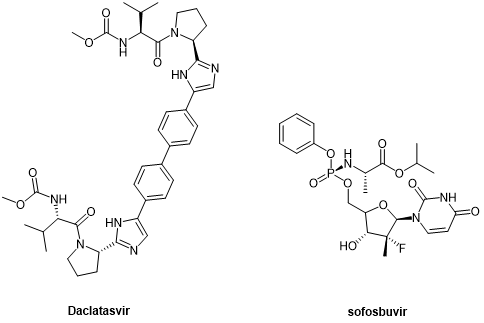 图10 . Daclatasvir 和 Sofosbuvir 的化学结构 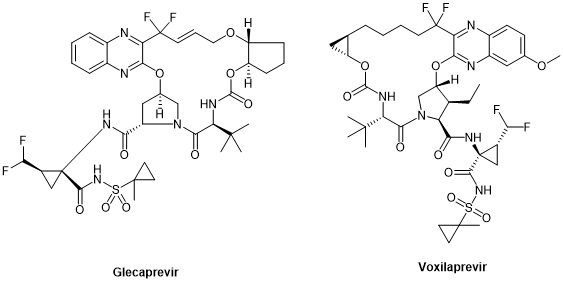 图11. Glecaprevir 和 Voxilaprevir 的化学结构 3. 抗HIV药物HIV治疗药物种类繁多,其中多种蛋白酶抑制剂具有肽类类似物特性。从第一代药物沙奎那韦到最新一代的达鲁那韦(darunavir),抗HIV蛋白酶抑制剂在稳定性、抗药性以及适用性方面不断优化。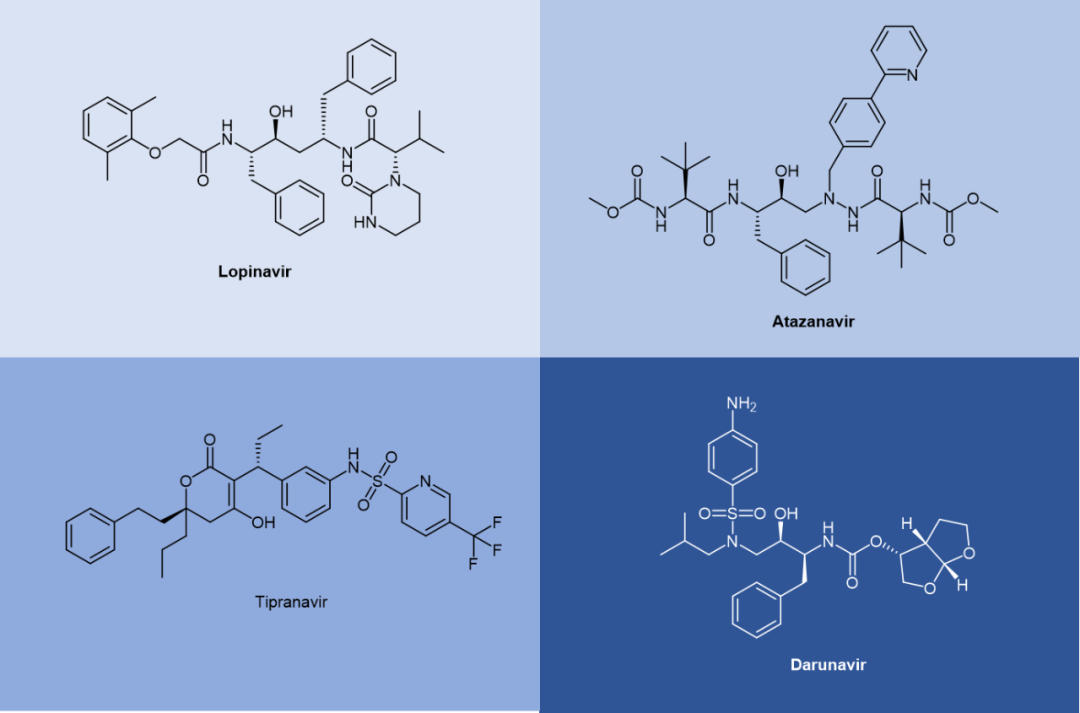 图12. 第二代抗HIV蛋白酶抑制剂  总结展望 总结展望
肽类类似物是医药化学中极具潜力的工具,凭借其在药效和药代动力学性能上的优势,正在逐步取代传统肽类药物。Paxlovid的成功证明了肽类药物在抗病毒领域的巨大价值。未来,随着科学家对病毒致病机制的深入研究,广谱抗病毒药物的开发将成为重点,期待更多以“vir”结尾的药物能够在疗效、安全性及抗药性等方面取得突破,为人类健康事业做出更大贡献。 参考文献 参考文献
Rossignol JF Nitazoxanide: a first-in-class broad-spectrum antiviral agent. Antiviral Res. 2014, 110: 94–103.
Rick Daniels; Leslie H. Nicoll. “Pharmacology – Nursing Management”. Contemporary Medical-Surgical Nursing. Cengage Learning, 2011. p. 397.
Kausar S, et al. A review: Mechanism of action of antiviral drugs. International Journal of Immunopathology and Pharmacology. 202135: 20587384211002621.
Yang, Y. Side Reactions in Peptide Synthesis. Elsevier. 2015, 22-28.King, T.A. et al. (2021) Photocatalytic methods for amino acid modification. Chem. Soc. Rev. 50, 39–57.
Robello, M. et al. The Alpha Keto Amide Moiety as a Privileged Motif in Medicinal Chemistry: Current Insights and Emerging Opportunities. J. Med. Chem. 2021, 64, 7, 3508–3545.
Nitshe, C. et al. Peptide–Boronic Acid Inhibitors of Flaviviral Proteases: Medicinal Chemistry and Structural Biology. J. Med. Chem. 2017, 60, 1, 511–516.
Kumari, S. et al. Amide Bond Bioisosteres: Strategies, Synthesis, and Successes. J. Med. Chem. 2020, 63, 21, 12290–12358.
Ghosh, A.K. et al. Recent progress in the development of HIV-1 protease inhibitors for the treatment of HIV/AIDS. 2016, J. Med. Chem. 59, 5172–5208.
Allerton, C. Pain Therapeutics: Current and Future Treatment Paradigms. Royal Society of Chemistry. 2013, pp. 56
Nageswara, D. et al. (2021) Discovery of quinoxaline-based P1–P3 macrocyclic NS3/4A protease inhibitors with potent activity against drug-resistant hepatitis C virus variants. J. Med. Chem. 64, 11972–11989.
Loos, N, H. et al. The Mechanism-Based Inactivation of CYP3A4 by Ritonavir: What Mechanism? Int. J. Mol. Sci. 2022, 23, 9866.
Kjellin, M. et al. The effect of the first-generation HCV-protease inhibitors boceprevir and telaprevir and the relation to baseline NS3 resistance mutations in genotype 1: experience from a small Swedish cohort. Ups. J. Med. Sci. 2018, 123 (1), 50−56.
Wei, L. et al. Long-term outcomes in patients with chronic hepatitis C in the current era of direct-acting antiviral agents. Expert Rev. Anti Infect Ther. 2019, 17 (5), 311−325.
Ghosh, A. K. et al. The FDA Approved HIV-1 Protease Inhibitors for Treatment of HIV/AIDS. In Burger’s Medicinal Chemistry and Drug Discovery, 7th ed.; Abraham, D. J., Rotella, D. P., Eds.; John Wiley & Sons: Hoboken, NJ, 2010; Vol. 7, pp 1−74.
Bold, G.; et al. New aza-dipeptide analogs as potent and orally absorbed HIV-1 protease inhibitors: candidates for clinical development. J. Med. Chem. 1998, 41, 3387−3401.
Doyon, L.; et al. Selection and characterization of HIV-1 showing reduced susceptibility to the non-peptidic protease inhibitor tipranavir. Antiviral Res. 2005, 68, 27−35. 天玑算·科研服务,提供计算模拟、CPU/GPU租用、服务器定制、超算集群建设、实验检测、免费计算课程等,50+全职计算工程师团队可满足您不同领域的计算需求,涉及第一性原理,分子动力学,有限元仿真,相图计算,机器学习等……工程师线上1对1了解您的需求,结合需求为您提供定制化理论计算方案!(微信:TJS10591) 推荐阅读
|
 |Archiver|手机版|小黑屋|Octave中文网学术交流论坛
( 黑ICP备2024030411号-2 )
|Archiver|手机版|小黑屋|Octave中文网学术交流论坛
( 黑ICP备2024030411号-2 )